作者:徐峰
庆大霉素C1a是一种关键的广谱氨基糖苷类抗生素,不仅是庆大霉素复合物的主要活性成分,也是合成依替米星等重要抗生素的关键中间体。传统化学方法生产该药物面临诸多技术瓶颈。利用天然宿主棘孢小单孢菌作为微生物细胞工厂进行生物制造,被视为一条更具潜力的可持续路径。然而,该菌株代谢网络复杂,调控机制不明,限制了其生产效能的充分发挥。因此,开发系统性的工程策略以突破其生产瓶颈,具有重要的科学价值与应用前景。
近日,我校太阳成集团tyc9728的田锡炜教授与储炬教授团队,在合成生物学与生物工程领域取得重要进展。通过整合多组学分析与智能发酵控制,成功构建了高产庆大霉素C1a的棘孢小单孢菌细胞工厂。该研究成果以“系统改造棘孢小单孢菌细胞工厂用于庆大霉素C1a的过量生产”为题发表在Trends in Biotechnology,为解决重要抗生素的高效生物制造提供了创新性策略。
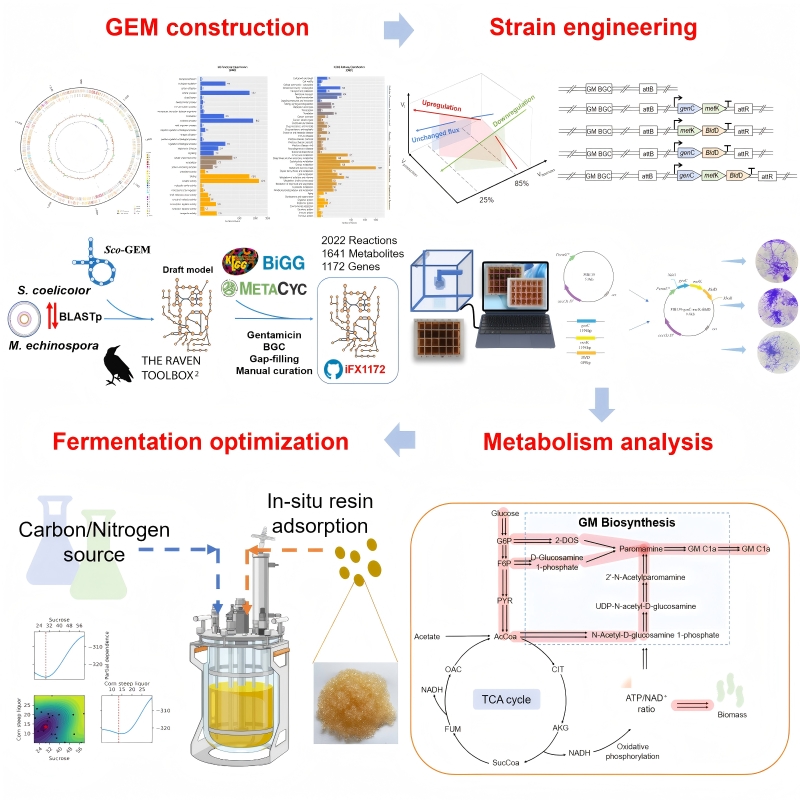
图片说明:系统改造棘孢小单孢菌细胞工厂的总体策略
研究团队首先对生产菌株进行了高质量全基因组测序与解析,绘制了其完整的遗传图谱。基于此,构建了首个针对棘孢小单孢菌的基因组尺度代谢模型iFX1172。该模型精确模拟了菌体的代谢网络,并通过13C标记实验验证了其预测细胞内代谢通量分布的可靠性,为后续的理性设计奠定了坚实基础。
其次,利用代谢模型进行系统性扫描,研究预测出多个与庆大霉素合成正相关的潜在基因靶点。实验验证表明,过表达2-脱氧-环肌醇合酶、甲硫氨酸腺苷转移酶等基因,能有效提升前体供应,使庆大霉素产量显著提高。同时,通过诱变与比较基因组学,团队发现了如BldD等传统模型难以预测的全局性调控因子,其过表达同样能强力驱动抗生素合成。
此外,研究团队将模型预测的途径靶点(genC, metK)与组学发现的调控靶点(BldD)进行组合优化。三重共表达工程菌株展现了最强的协同效应,使庆大霉素C1a产量较原始菌株提升34.3%。更重要的是,该组合策略在其他氨基糖苷类抗生素的生产中也普遍适用,产量提升最高达1.6倍,证明了其广泛的工程应用潜力。
最后,为进一步突破发酵过程中产物反馈抑制的瓶颈,研究采用了贝叶斯优化算法智能搜寻最佳碳氮源配比,将产量再次提升。最终,结合原位吸附技术及时移走发酵液中的产物,工程菌在5升发酵罐中实现了964.1 mg/L的庆大霉素C1a产量,这是原始菌株产量的近六倍,生产效率达到6.7 mg/L/h,创造了该产品生物制造的新纪录。
上述成果先后发表于国际权威期刊Trends in Biotechnology。其中第一作者为我校太阳成集团tyc9728博士后徐峰,通讯作者为田锡炜教授和储炬教授。该系列研究获得国家重点研发计划、上海市碳中和基础研究特区、上海市自然科学基金等项目的资助。
论文链接:DOI:10.1016/j.tibtech.2025.12.006